 今回の研究から導かれたタンパク質構造安定性のメカニズムは、以下の2点。
今回の研究から導かれたタンパク質構造安定性のメカニズムは、以下の2点。
- 水を介した間接的相互作用は、内部に埋もれた非極性基における水への露出による寄与も含め、タンパク質の変性構造に対して有利に働く(つまり、水はタンパク質の天然構造をむしろ不安定化させている)
- タンパク質分子内に働くファンデルワールス力などの直接相互作用は、水を介した間接的相互作用による不安定化に打ち勝ち、天然構造の安定化を導く
これは、従来説の「疎水基が水を嫌っている」というのは誤りであり、疎水基は実は水が嫌いではなかったということを示すが、疎水基同士の間で働くファンデルワールス力の方が強いため、疎水基は水と相互作用するより、疎水基同士で集合するというメカニズムが示されたと研究チームでは説明する。
https://news.mynavi.jp/article/20210906-1966142/長年信じられてきた「疎水基が水を嫌う」というイメージは間違いだったことが判明
岡山大学と立命館大学は9月3日、独自に開発した理論計算を駆使して、これまで約60年にわたって広く信じられてきたタンパク質の変性メカニズム「疎水性相互作用仮説」の問題点として、「疎水基が水を嫌う」というイメージは誤りであることを明らかしたほか、その代替となる安定化メカニズムを提案したことを発表した。
同成果は、岡山大 異分野基礎科学研究所の墨智成准教授、立命館大 生命科学部応用化学科の今村比呂志助教らの共同研究チームによるもの。詳細は、タンパク質科学会が発行する学術誌「Protein Science」に掲載された。
タンパク質は、アミノ酸がペプチド結合でつながったポリペプチド鎖の構造を持ち、その結合順は一次構造と呼ばれ、それに応じて、タンパク質は生体機能を発現する固有の立体構造を自発的に形成、その三次元構造は「天然構造」と呼ばれている。
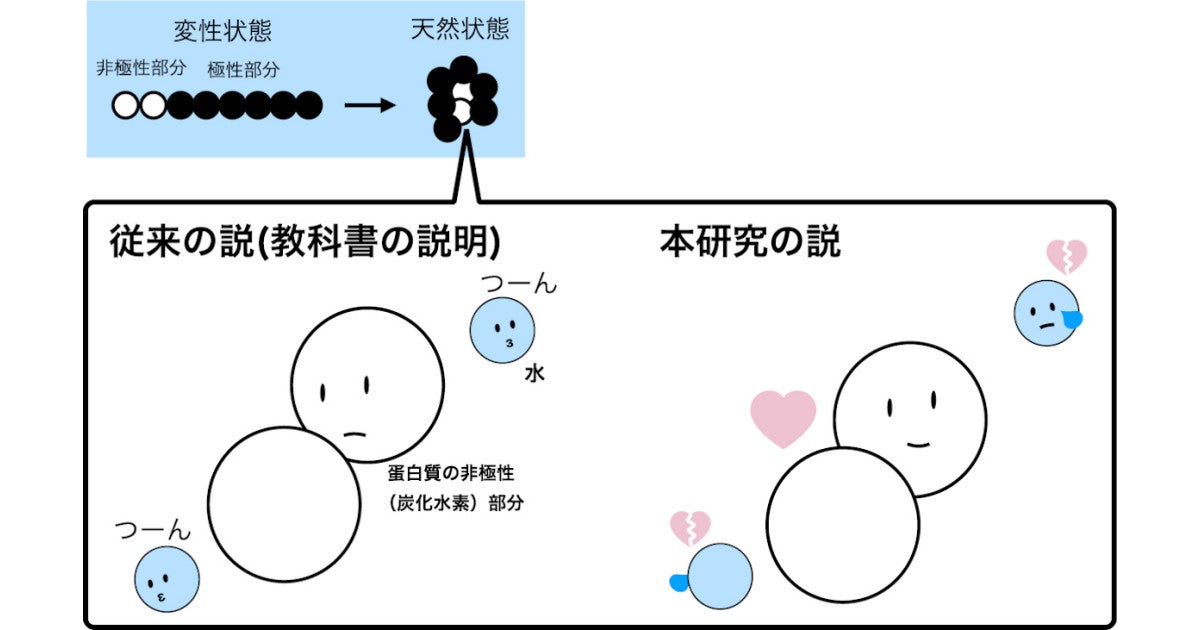
タンパク質が正しく働くためには、規則性が失われた変性状態から天然状態へと変化する必要があるが、従来は、タンパク質の疎水基(非極性(炭化水素)部分)が水を避けるように(水から絞り出されるように)集合する"疎水効果"で、天然構造が安定化されていると説明されてきた。
-
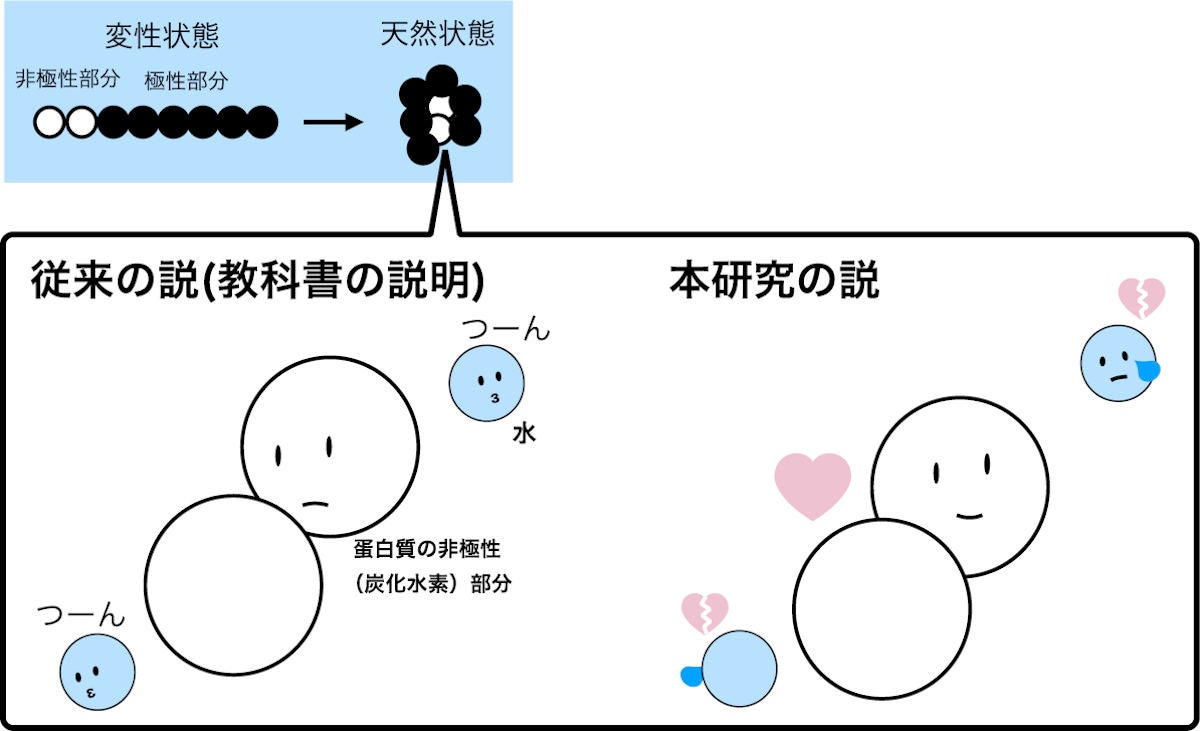
タンパク質の安定化メカニズムのイメージ図。(左)従来説。疎水基が水を避けるように集合する効果により、天然構造が安定化されているとされてきた。(右)今回発表された説。疎水基は水と相互作用していた方がエネルギー的に安定であることが判明した (出所:岡山大プレスリリースPDF)
1980年代後半から1990年代にかけて、日本人研究者らをはじめとする大井-大畠-Makhatadze-Privalovの計算方法(OOMP法)により、タンパク質分子内の直接的な相互作用の重要性が見直されはしたものの、「タンパク質の非極性部分は水に露出しない方がタンパク質の天然構造を安定にする」という、疎水効果の仮説の本質は依然として支持されてきたという。
そこで研究チームは今回、疎水効果によって安定化するといわれるコイルドコイル構造を持つヘリックス「GCN4-p1」をモデルタンパク質として採用し、熱力学的サイクルを適用。液体の密度汎関数理論を用いて、ヘリックス二量体の解離に伴う水を介した間接的相互作用と、タンパク質上のすべての電荷を仮想的にゼロにすることにより得られる非極性相互作用による寄与を計算。その結果、間接的相互作用だけでなく、非極性基による寄与の上限についても、ヘリックス解離に対して、むしろ有利に働くことが判明。従来のOOMP法による予測とは反対の結論を示す結果を得たという。
-
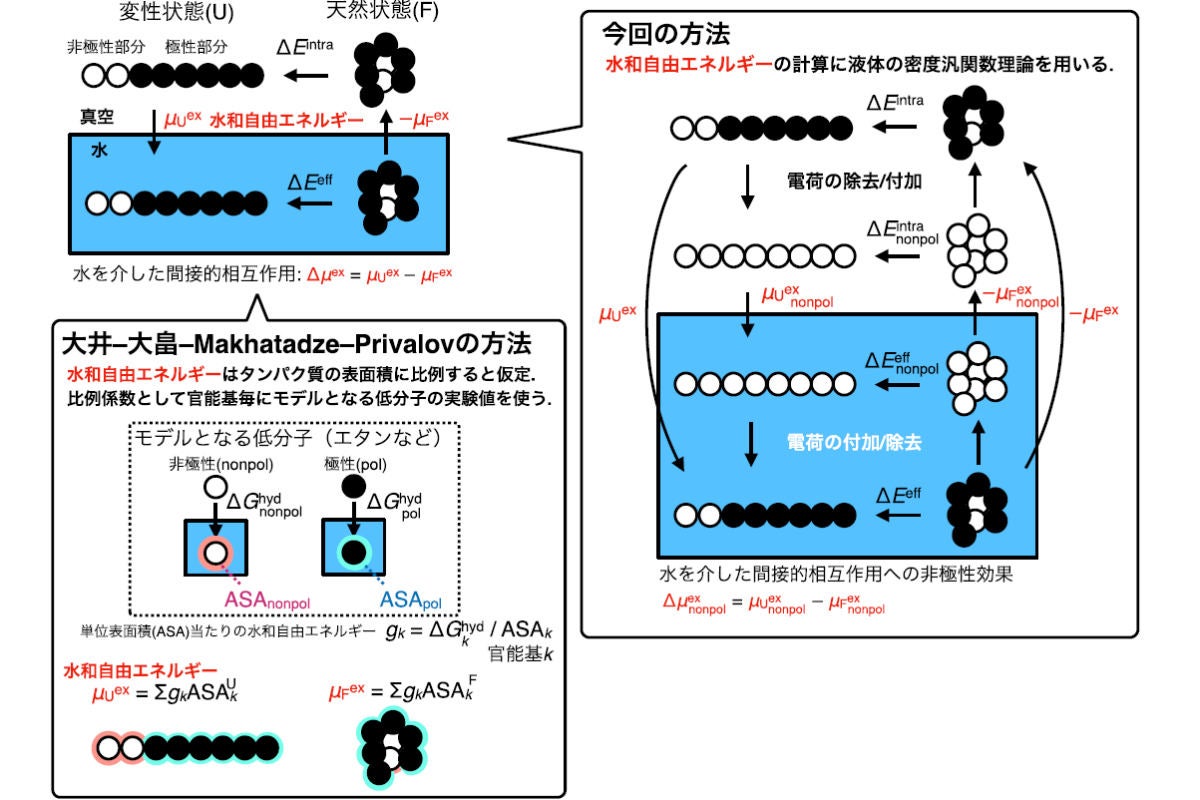
タンパク質の変性の熱力学サイクルとその計算方法。(左下)OOMP法では、水和自由エネルギーをタンパク質の表面積に比例すると仮定し、比例係数として官能基ごとにモデルとなる低分子の実験値を用いている。(右)今回の研究では、水和自由エネルギーの計算に液体の密度汎関数理論が用いられており、OOMP法のような仮定は入らない (出所:岡山大プレスリリースPDF)
さらに、この矛盾は、OOMP法で経験的に採用されている各官能基の寄与における、水への露出表面積に基づく加成性に帰着することが見出された。これは、露出表面積に基づく各残基が寄与する計算において、タンパク質内部に埋もれた残基による寄与が加算されていなかったためで、結果として、その空孔形成エネルギーが考慮されていないため、埋もれた残基を数多く有する天然構造の安定性(ギブズエネルギー)を、常に過小評価するという理論的欠陥があることが判明したとする。
今回の研究から導かれたタンパク質構造安定性のメカニズムは、以下の2点。
- 水を介した間接的相互作用は、内部に埋もれた非極性基における水への露出による寄与も含め、タンパク質の変性構造に対して有利に働く(つまり、水はタンパク質の天然構造をむしろ不安定化させている)
- タンパク質分子内に働くファンデルワールス力などの直接相互作用は、水を介した間接的相互作用による不安定化に打ち勝ち、天然構造の安定化を導く
これは、従来説の「疎水基が水を嫌っている」というのは誤りであり、疎水基は実は水が嫌いではなかったということを示すが、疎水基同士の間で働くファンデルワールス力の方が強いため、疎水基は水と相互作用するより、疎水基同士で集合するというメカニズムが示されたと研究チームでは説明する。
今回の成果を受けて、研究チームでは、これまで約60年もの間信じられてきた疎水性相互作用仮説に対する再考を強く示唆するものだとしているほか、従来の疎水性相互作用仮説でうたわれていたのとはむしろ逆の効果があることも示唆されるとしており、水によって促される構造的な揺らぎは、機能発現に対して多大なる影響を与えることが示唆されるとしている。
0 件のコメント:
コメントを投稿